新闻中心
您的「PCR实验室」是这样建设和质控了吗?
发布时间:2025-01-27
来源:安徽维高环境科技 浏览次数:
PCR实验室建设的主要目标是为PCR检验提供一个安全、规范、方便、适宜的环境和场所。PCR检验是一项要求高、技术性较强的工作,为了确保PCR检验工作的顺利进行,保证PCR检验工作的质量, 实验室的建设,包括实验室工作区域的设置、设备配置、质量控制和质量保证、清洁及废弃物处理等非常重要。
环境和场所作为实验室检验中非常关键的一个要素,在PCR检验中同样至关重要。目前,在我国相关国家标准、行业标准、实验室认可指南、国家相关部委公告等文件中均对PCR实验室的设计和建设都给出了明确的要求,把涉及基因扩增的实验室包括PCR实验室的建设和管理纳入了法制化、规范化的轨道。
PCR 实验室工作区域的设置和要求
PCR实验室的设计和布局应符合相关法律法规的要求,符合GB/T 27025-2008《检测和校准实验室能力的通用要求》,为避免污染、确保生物安全必须严格遵循GB/T 19495.2-2004《转基因产品检测实验室技 术要求》、及GB 19489-2008《实验室 生物安全通用要求》、GB 50346-2011《生物安全实验室建筑技术规范》等标准要求建设PCR实验室。实验室设计应将不相容活动区域进行有效隔离,合理设计实验分区,防止不同区域间的交叉污染对实验结果造成影响,并确保检测工作区域中的生物、化学、辐射、和物理危险 控制在已经过评价的、适当的风险程度,应考虑意外伤害和职业病风险,并尽量将其风险降到最低,同时,还要保证所有工作人员和外来人员免受已知危害的伤害。
PCR实验室通常划分为五个工作区域:试剂贮备和准备区、样品制备区、PCR反应配制区、扩增区、扩增产物分析区。五个工作区应按照清洁、半污染到污染的顺序排列。有条件的实验室宜在各工作区域设置缓冲间,缓冲间压力应为负压(或上设抽风装置),与其相连的工作区域为正压。工作区域与缓冲间宜安装磁性连锁装置。受场所限制无条件设置缓冲间的实验室,在对检测区域进行功能划分后,应根据标准要求设置各工作区域的压力。每个区域应为独立的工作区,要设置明显的标志,如负责人的姓名、污染级别、联系人、联系电话、准入要求等,并清晰标记出国际通用的危险标识(如生物危险标识、放射性标识等)。各个区域不能直接相通,如果是紧密相连的区域,则需要安装物品传递窗。进入各个工作区域须严格遵循单一方向顺序,即只能从试剂贮存和准备区、样品制备区、PCR反应配制区、扩增区至扩增产物分析区,避免发生交叉污染。实验室应当配备相应的安全消防保障条件和措施,在使用、存放及处理放射性、爆炸性、毒害性和污染性物质时,应符合有关安全、防护、疏散、环境保护等规定。
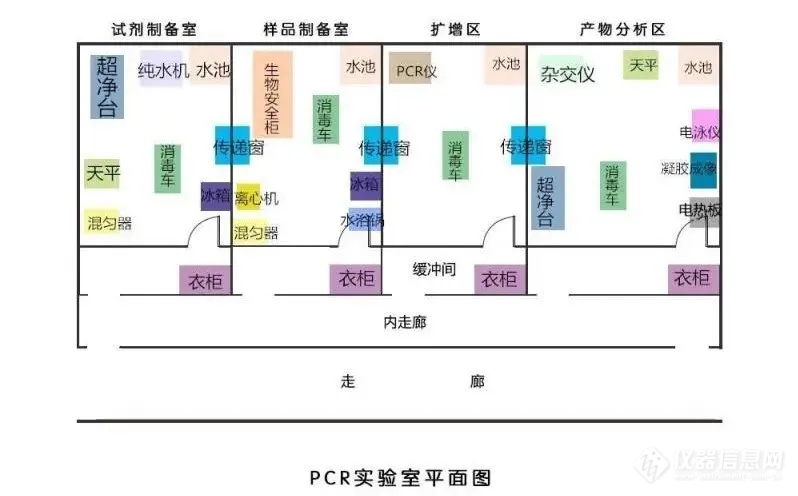
(一)试剂贮存和准备区
该工作区域如未设缓冲间,压力应为正压。本区的功能是实验室相关试剂(如核酸提取液、乙醇等)的配置和贮存(包括商业化的试剂,如PCR反应缓冲液、Taq 酶和 dNTPs等)。当试剂经过技术性验收符合要求后,为避免经常打开保存管操作造成污染及反复的冻融,应将试剂分装贮存备用。贮存试剂的分装体积根据实验室内一次测定所需的扩增反应数来确定。试剂应按照其贮存条件进行存放,通常为冰冻贮存。在本区的实验操作过程中,操作者必须戴手套,并经常更换。此外,操作中使用一次性帽子也是一个有效地防止污染的措施。严禁用嘴吸取液体,加样器和吸头等必须经高压灭菌处理。
(二)样品制备区
该区域如未设缓冲间,压力应为负压或减压,可以安装排风系统。本区的功能为待检样品的保存、核酸的提取、贮存等。如在该区域内还需进行RNA检测,应辟出专门RNA操作区,或安装二级生物安全柜或外排风式的排风橱来替代。此区应远离其他实验操作区,粉碎样品时的器皿要单独使用,所有的器具在使用前须经过彻底清洗并高压消毒,防止交叉污染,称取的待测试样品应加盖后再转移至PCR反应配制区。
由于在加样操作中可能会发生气溶胶所致的污染,所以应避免在本区内不必要的走动。用于RNA扩增检测样本制备好以后,应立即进行cDNA合成,因为cDNA链较RNA 稳定,保存相对容易。为保证逆转录反应的需要,应在样品制备区设置温育装置。
(三)PCR反应配制区
该区域如未设缓冲间,压力应为负压或减压,可以安装排风系统。本区的功能为配制、分装PCR主反应混和液以及加入核酸模板。已纯化的核酸应保存于-20°C或-80°C,避免反复冻融,阳性和阴性标准物质DNA可调整至常用的浓度后分装并冷冻保存。对于使用巢式PCR进行检测的实验室,建议在此区域安装二级生物安全柜或外排风式的排风橱,第一轮的扩增产物添加至第二轮的主反应混和液的操作可以在此区 域进行。
(四)扩增区
该区域如未设缓冲间,压力应为负压或减压,可以安装排风系统。本区的功能为核酸扩增。加了DNA或RNA等模板的反应管应盖好盖子后拿到本区域。
如未设置PCR反应配制区,已制备的DNA、RNA模板或合成的cDNA(来自样本制备区)的加入和主反应混合液(来自试剂贮存和制备区)制备成反应混合液等也可在本区内进行。在巢式PCR测定中,通常在第一轮扩增后必须打开反应管,因此巢式PCR扩增有较高的污染危险性,第二次加样必须在本区内进行。不能从本区再进入任何"上游"区域。为避免气溶胶所致的污染,应尽量减少在本区内的走动,如需要加样则应在超净台(气流方向宜选择垂流式)或生物安全柜内进行。打开预处理过的反应混合液时必须防止液体溅出,尤其是在巢式PCR仪扩增步骤之间。防止液体溅出的一个简单的方法是在打开反应管前快速离心数秒。
(五)扩增产物分析区
该区域如未设缓冲间,压力应为负压或减压,应安装排风系统。本区的功能为扩增产物的测定。此区是最主要的扩增产物污染来源,应远离其他实验操作区,还应注意避免通过本区的物品及工作服将扩增产物带出。在使用PCR-ELISA方法检测扩增产物时,必须使用洗板机洗板,废液须收集至1mol/L HCl中,且不能在实验室内倾倒,应至远离PCR实验室的地方弃掉。用过的移液器吸头也必须放至1mol/L HCl中浸泡后再放入垃圾袋中按程序处理。
PCR 实验室设备配置
设备是实验室硬件建设的基础,是实验室重要技术要素之一。实验室能否准确、客观报告每一项检测结果,正确选择使用合适的设备是前提条件。在设施和环境条件满足需要后,就要给PCR实验室配备检测所需要的仪器设备。PCR实验室通常分为五个区域,每个区域都应配备专用的仪器设备,并且应加贴明确的标识,避免不同区域内的设备,特别是微量移液器等小设备发生混淆或误用,从而造成环境 或样品污染,
影响检测结果。
(一)PCR实验室常用设备种类
1. 温控设备:包括冰箱(4°C,-20°C,-80°C)、恒温水浴、恒温箱和液氮罐等。
2. 水净化设备:纯水仪,用于制作符合分子生物学使用标准的去离子水或超纯水。
3. 消毒设备:紫外灯、高压锅和干热灭菌器等。
4. 量值设备:包括各种型号的移液器、量筒和pH计等。
5. 离心设备:如冷冻离心机、水平离心机和掌式离心机等。
6. 电泳设备:如电泳仪和电泳槽等,用于核酸和蛋白的检测。
7. DNA热循环仪(PCR 仪):如普通PCR仪、梯度PCR仪、荧光PCR仪等,用于核酸的扩增,可进行定性和定量检测。
8. 凝胶成像系统:用于电泳结果的观察、拍照和分析。
9. 核酸蛋白分析仪:通过核酸和蛋白在紫外260 nm和280 nm有不同吸收峰的特性,用于核酸和蛋白的定量检测及提取的DNA纯度的检测。
10. 制冰机:用于制造大多数核酸和蛋白的实验操作所需的低温环境,以减少核酸酶和蛋白酶的降解。
11. 微波炉:用于一些溶液的快速加热。
12. 工作环境保障设备:生物安全柜、超净工作台等。
13. 超声破碎仪:用于组织匀浆,样品的提取。
14. 安全防护设备:用于紧急情况下实验室及工作人员的安全防护,如洗眼装置、紧急喷淋等。
(二)PCR实验室各区域设备配置
(1)试剂储存和准备区
1. 4°C和-20°C冰箱
2. 混匀器
3. 掌式离心机
4. 微量移液器(覆盖1uL-1000uL)
5. 移动紫外灯
(2)样品制备区
1. 4°C和-20°C冰箱
2. 冷冻离心机
3. 混匀器
4. 水浴箱或加热模块
5. 生物安全柜或超净工作台
6. 超声破碎仪
7. 超声波水浴仪(如需处理大分子DNA,应配备)
8. 纯水仪
9. 微量移液器(覆盖1uL-1000uL)
10. 可移动紫外灯
(3)PCR反应配制区
1. -20°C冰箱或-80°C冰箱
2. 生物安全柜或超净工作台
3. 掌式离心机
4. 制冰机
5. 微量移液器(覆盖1uL-1000uL)
6. 移动紫外灯
(4)扩增区
1. DNA 热循环仪(PCR 仪)
2. 生物安全柜或超净工作台台(气流方向宜选择垂流式)
3. 微量移液器(覆盖1uL-1000uL)
4. 可移动紫外灯
(5)扩增产物分析区
1. 电泳设备
2. 凝胶成像系统
3. 核酸蛋白分析仪
4. 微量移液器(覆盖1uL-1000uL)
5. 可移动紫外灯
各个工作区域还应该配备消耗品:一次性手套、一次性吸水纸、耐高压处理的离心管和移液器吸头; 专用工作服和工作鞋、清洁用具;专用办公用品。以上这些物品应保证在各自区域内使用,不能交叉使用。
PCR 实验室质量控制和质量保证
(一)实验前的质量控制
(1)人员
实验操作人员应具备良好的分子生物学专业技术操作规范。PCR 都是微量操作,要想获得稳定可靠的 检测结果,操作人员就需要一定的专业技术知识与经验,要尽可能做到知其然又知其所以然。从实际工作 中来看,不同的操作者所获得的测定结果往往差异也很大,因此,人员培训相当重要,尤其是内部针对性 的培训。
(2)环境
实验室的设计和布局应符合相关法律法规的要求,生物安全方面要符合 GB19489-2008 的规定。要将 不相容活动的相邻区域进行有效隔离,合理设计实验室分区,进入各个工作区域须遵循单一方向顺序,即 只能从试剂贮存和准备区、样品制备区、PCR 反应配制区、扩增区至扩增产物分析区,防止不同区域间的 交叉污染对检测结果造成的影响。总结为一句话就是:严格遵守“各区独立、单一方向”。对影响检测质 量的区域的进入和使用,也要加以控制,非实验有关人员和物品不能随便进入。
(3)仪器设备
仪器设备的正确使用、维护和校准是保证 PCR 结果准确的前提。对实验室中的仪器设备,如扩增仪、 离心机、移液器、生物安全柜等应建立一套规范化、标准化的操作程序。各实验区域应有专用的仪器设备, 每台设备要加贴唯一性标签,同一区域内的仪器设备、物品和工作服应有明显标记,避免与其他区域混用。
(4)试剂
PCR 实验室使用的试剂等级应为不含DNA和DNase的分析纯或生化试剂(另有规定的除外)。试剂 到达实验室后,需要经过符合性验收,关键试剂(包括核酸提取试剂、RNase、蛋白酶 K、阴性对照标准物质、阳性对照标准物质、Taq 酶、限制性内切酶、引物、探针、菌种、阳性质粒等)应经过技术性验收,合格后方能使用。实验用水应符合一级水的规格,去离子水的电阻需达到18.2 Ω。商品试剂盒应注明到货日期,菌种、质粒、动植物细胞组织的贮存和保管应符合相关标准和法律法规的要求。所有试剂应按其规定的贮存条件存放。实验室使用的试剂宜大体积配置、小体积分装后高压灭菌保存,不能高压灭菌的试 剂应过滤(0.22μm)除菌,PCR主反应液、引物及探针应避免反复冻融。配置的试剂应在容器上标明试剂名称、浓度、配置时间、保存条件、失效日期、配制人等信息。
(5)样品
实验室收到的样品时,应确认其包装完好无损;进入实验室后应加贴唯一性标识;在对样品进行混和、样品制备和称量过程中要避免交叉污染。

(二)实验过程中的质量控制
做好PCR检测的最重要的工作之一就是尽可能得防止污染。PCR 实验室中主要的污染来源包括:
1. 样品间交叉污染:主要是由于样品在运输、储存、放置过程中处置不当,或是样品核酸在提取过 程中操作不当造成的样品间的污染。
2. 试剂的污染:由于操作不当,造成核酸提取、扩增过程中各相关试剂的污染。
3. PCR 扩增产物污染:这是 PCR 实验中最主要最常见的污染,极微量的 PCR 产物污染就可造成假 阳性。最可能造成PCR产物污染的形式是气溶胶污染,操作时比较剧烈地摇动反应管、开盖、反复吹吸样 液都可能形成气溶胶而引起污染。
4. 克隆质粒的污染:在用克隆质粒做阳性对照时,有时会出现克隆质粒的污染。
5. 实验器具的污染:如移液器的污染等。
6. 防止污染的方法:污染重在预防,为了避免实验室污染,获得准确、可靠的检测结果,实验室应制定一套具体可行的污染防护措施并严格执行。
7. 防止防污的主要措施有:严格实验室分区及严格遵守实验室工作制度,不同分区的物品不得混用;操作人员要有良好的习惯,实验操作要规范正确;实验器具和试 剂的规范使用;建立外来人员登记程序;每次实验后的清洁消毒等。
(三)检测结果质量控制
为确保 PCR 实验室检测结果质量,在检测样品时,需要设置以下对照:
1. 阴性质控对照:包括核酸提取空白对照(核酸提取过程中不加样品的空白管)、PCR 试剂对照(不含DNA/cDNA模板的PCR扩增反应液试剂、阴性目标DNA对照)(即为内源基因对照,是不含外源目标核酸序列片段的模板,可以使用阴性标准物质,并与测试样品等同处理进行核酸提取及扩增)。
2. 阳性质控对照:阳性目标DNA对照,即使用含有目标DNA/RNA序列片段的阳性标准物质和质粒。
(四)外部质量评价测试
外部质量评价测试的主要方式包括:能力验证、测量审核、实验室间比对。凡是对外开展PCR检测并出具检测报告的实验室,应按要求定期参加国家有关法定部门组织的检验项目的外部质量评价测试。
声明:本网站发布的内容(图片、视频和文字)以原创、转载和分享网络内容为主,如果涉及侵权请尽快告知,我们将会在第一时间删除。文章观点不代表本网站立场,如需处理请联系客服。电话:18956539761。
本站全力支持关于《中华人民共和国广告法》实施的“极限化违禁词”的相关规定,且已竭力规避使用“违禁词”。故即日起凡本网站任意页面含有极限化“违禁词”介绍的文字或图片,一律非本网站主观意愿并即刻失效,不可用于客户任何行为的参考依据。凡访客访问本网站,均表示认同此条款!反馈邮箱:365667427@qq.com。
立即与我们取得联系
如果您对我们的产品和服务感兴趣,您可以通过右侧客服微信联系我们或直接致电,我们将尽快回复您。
 微信扫码咨询
微信扫码咨询24小时服务热线:189-5653-9761(微信同号)
>